
美国Avidity公司6月9日对外宣布delpacibart braxlosiran(del-brax)在美国的加速批准监管途径开放,用于治疗面肩肱肌营养不良症(FSHD)。此外,公司宣布已启动其全球确证性3期FORWARD™研究,旨在支持随后在美国和全球其他国家/地区的FSHD患者对del-brax的全面批准。
Del-brax是第一个旨在通过直接靶向致病基因双同源框4(DUX4)来治疗FSHD根本原因的研究性疗法。目前,尚无批准的疗法用于治疗FSHD,FSHD是一种罕见的遗传性疾病,其特征是终生、无情地丧失肌肉力量和功能、显著疼痛、疲劳和肢体残疾。FSHD在美国和欧洲影响了大约45,000至87,000人。
Avidity公司开发治疗FSHD疾病疗法的药物名为:del-brax

Avidity总裁兼首席执行官Sarah Boyce表示:“此次宣布的监管和临床开发进展反映了我们在罕见神经肌肉疾病方面的持续领导地位,并使我们离为 FSHD社区提供可能对他们的疾病产生有意义影响的治疗选择更近了一步。“我们已经与FDA确认,del-brax的加速批准途径是开放的。此外,我们已经启动了全球验证性3期研究,旨在支持我们对del-brax的全球批准战略。”

除了加速批准途径的标准指南外,FDA还就替代生物标志物的必要验证步骤向该公司提供了详细指导。FDA的加速批准计划旨在允许治疗严重疾病的药物的早期批准,并根据替代终点填补未满足的医疗需求。替代终点是一种标志物,例如实验室测量、放射学图像、体征或其他被认为可以预测临床益处但其本身不是临床益处的指标。使用替代终点可以大大缩短获得FDA 批准之前所需的时间。制药公司仍然需要进行研究以确认预期的临床益处。

为了支持完全批准,Avidity公司启动了名为FORWARD的项目,这是一项全球性的、验证性的3期、随机、安慰剂对照、双盲、为期18个月的研究,旨在评估北美、欧洲和日本约200名FSHD患者(16-70 岁)每六周2mg/kg的del-brax。FORWARD旨在评估与FSHD相关的关键终点,这些终点测量功能活动度(10MWRT 和 TUG)、力量(QMT) 和患者报告的结果。FORWARD的灵活设计使公司能够从正在进行的FORTITUDE™生物标志物队列中收集更多数据,并将这些指标中的任何一项提升到主要终点。目前,QMT被分配为主终端节点。

FSHD协会首席执行官Mark Stone表示:“FSHD患者会经历严重且不可预测的肌肉流失,以及疾病将如何发展的持续不确定性。我们感谢Avidity公司的创新方法,该方法考虑了我们社区的反馈,特别是在开发生物标志物时,该方法提供了对FSHD真实全身负担的见解。这项研究有助于寻找一种监管途径,使del-brax可以更快地为FSHD社区提供。这一进展,以及 FORWARD3期研究的启动和 FORTITUDE 的出色del-brax数据,为那些迫切需要治疗方案的人带来了真正的希望。”
关于3期FORWARD™试验



FORWARD™是一项全球性的、验证性的3期、随机、安慰剂对照、双盲、为期18个月的研究,旨在评估大约200名FSHD患者(16-70 岁)的delpacibart braxlosiran(del-brax)。该试验将在全球大约45个地点进行,包括美国、加拿大、欧洲和日本。患者将每六周2mg/kg的del-brax或安慰剂 (1:1)。遵循监管一致性,FORWARD旨在成为一项验证性研究,以支持 del-brax 的潜在全面批准。FORWARD 正在评估del-brax对关键FSHD相关终点的影响,这些终点测量功能活动度(10米步行跑步测试,-10MWRT,以及Timed Up and Go- TUG)、力量(定量肌肉测试,-QMT,总分)、患者报告结果(PRO)和KHDC1L(一种新型循环生物标志物)的减少。所有研究参与者,无论他们是接受积极治疗还是安慰剂,都可以选择参加开放标签扩展试验。
关于1/2期FORTITUDE™和2期FORTITUDE-OLE™试验
资讯 | 美国Avidity公司宣布在del-brax 1/2 期FORTITUDE试验中完成生物标志物队列的招募,用于FSHD
最新资讯 | 美国Avidity公司公布2025年关于FSHD临床试验药物del-brax项目最新计划
FORTITUDE™试验是一项随机、安慰剂对照、双盲、1/2期临床试验,旨在评估90名面肩肱肌营养不良症(FSHD)参与者的单剂量和多剂量delpacibart braxlosiran{del-brax}。FORTITUDE正在评估静脉注射del-brax 的安全性、耐受性、药代动力学和药效学。正在使用关键生物标志物评估del-brax的活性,包括DUX4调节的肌肉和循环生物标志物以及肌肉体积和成分的磁共振成像(MRI)测量。尽管1/2期试验在统计上无法评估功能益处,但它探讨了del-brax的临床活性,包括功能活动度和肌肉力量的测量,以及患者报告的结果和生活质量测量。
该试验共有三个剂量队列。前两个剂量递增队列评估了2 mg/kg或4 mg/kg的del-brax与安慰剂的对比,旨在评估安全性并为其他研究提供 del-brax的剂量和剂量方案信息。Avidity公司已完成剂量递增队列的招募,并确定每六周2mg/kg的del-brax作为未来临床试验的剂量。
FORTITUDE试验中的第三个正在进行的生物标志物队列评估了del-brax 每六周2mg/kg与安慰剂相比对16-70岁FSHD患者12 个月的影响。生物标志物队列的主要终点是 KHDC1L 的减少,KHDC1L是一种新型DUX4调节的循环生物标志物。生物标志物队列的入组已完成,研究正在进行中。
完成FORTITUDE 的参与者可以选择参加正在进行的FORTITUDE开放标签扩展(FORTITUDE-OLE™) 研究,该研究评估del-brax在FSHD 参与者中的长期安全性和耐受性。
关于Del-brax
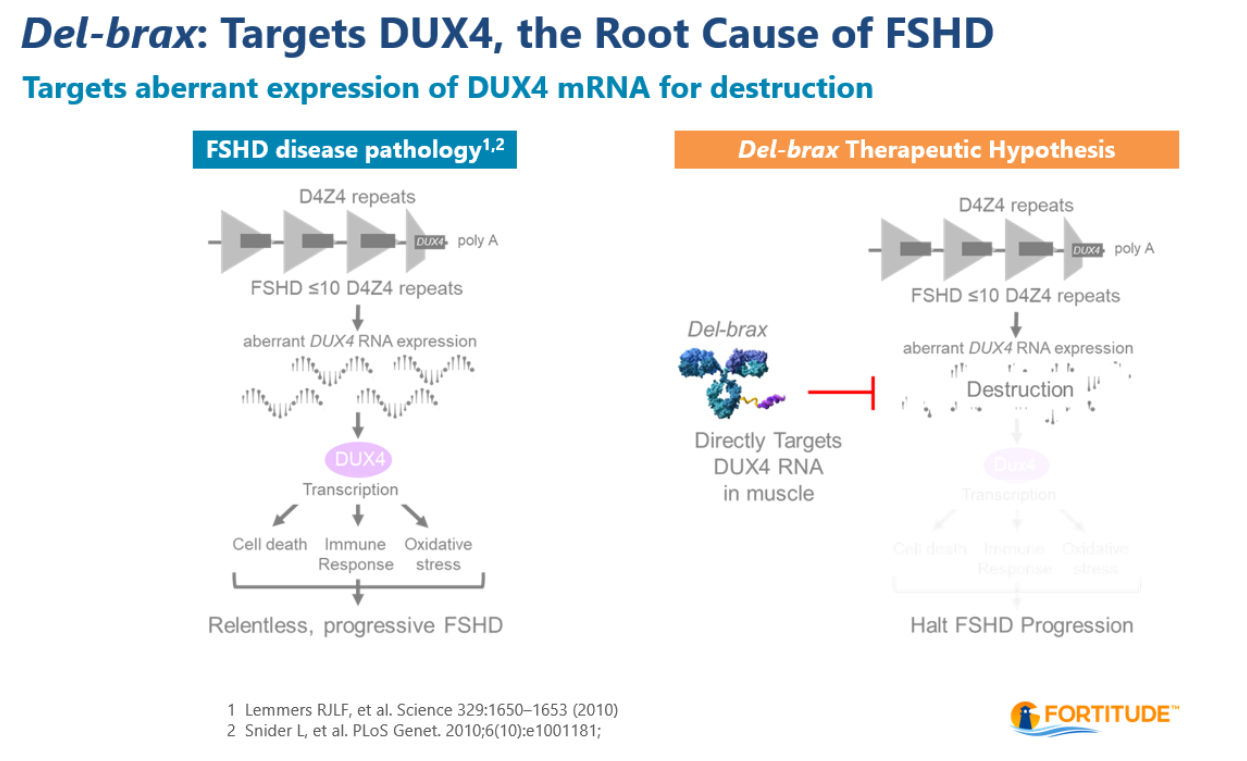
Del-brax旨在治疗FSHD的根本原因,FSHD是由称为双同源框4或DUX4 的基因异常表达引起的。DUX4蛋白的异常表达导致肌肉细胞中基因表达的变化,这与FSHD患者终生、进行性肌肉功能丧失有关。Del-brax旨在降低FSHD患者肌肉中DUX4 mRNA和DUX4蛋白的表达。Del-brax由一种专有的单克隆抗体组成,该抗体与转铁蛋白受体1(TfR1)结合,并与靶向 DUX4 mRNA的siRNA偶联。Del-brax目前处于注册阶段研究,包括 FORTITUDE生物标志物队列和FSHD患者的全球验证性3期FORWARD试验。美国食品药品监督管理局(FDA)和欧洲药品管理局(EMA)已授予del-brax 孤儿药资格认定,FDA已授予del-brax快速通道资格。
资讯 | 美国Avidity公司的药物AOC1020获得FDA【孤儿药称号】,用于治疗FSHD
资讯 | FDA授予美国Avidity公司用于面肩肱型肌营养不良症的研究药物“AOC1020”快速通道指定
关于面肩肱肌营养不良症(FSHD)
面肩肱肌营养不良症(FSHD)是一种罕见的、进行性的、多变的遗传性肌无力疾病,其特征是终生、持续的肌肉功能丧失、明显的疼痛、疲劳和进行性残疾。它的特征是进行性且通常不对称的骨骼肌损失,最初导致面部、肩部、手臂和躯干的肌肉无力,然后发展为下半身肌肉无力。FSHD是一种常染色体显性遗传疾病,由骨骼肌中DUX4 (双同源框 4)基因的异常表达引起,它激活了对肌肉细胞有毒的基因,并导致一系列下游事件,导致骨骼肌萎缩和肌肉功能受损。骨骼肌无力会导致全身的身体受限,包括无法抬起手臂超过几秒钟、失去展示面部表情的能力和严重的语言障碍。这些症状导致许多受 FSHD 影响的人变得依赖使用轮椅来行动。目前,没有批准的FSHD患者治疗方法。
关于Avidity公司

Avidity Biosciences, Inc. 的使命是通过提供一类新型RNA疗法–抗体寡核苷酸偶联物(AOC™)来深刻改善人们的生活。Avidity正在通过其专有的AOC彻底改变RNA领域,AOC旨在将单克隆抗体的特异性与寡核苷酸疗法的精确性相结合,以解决现有RNA疗法以前无法达到的靶点和疾病。利用其专有的AOC平台,Avidity展示了有史以来首次成功地将RNA靶向递送到肌肉中,并在三种罕见神经肌肉疾病的临床开发项目方面处于领先地位:1型强直性肌营养不良症(DM1)、杜氏肌营养不良症(DMD)和面肩肱肌营养不良症(FSHD)。Avidity还在推进两款全资拥有的精准心脏病学开发候选药物,以解决罕见的遗传性心肌病。此外,Avidity正在扩大AOC的影响力,通过其推进和扩大的管道,包括通过关键合作伙伴关系在心脏病学和免疫学方面的项目。Avidity总部位于美国加利福尼亚州圣地亚哥。
前沿资讯 | 美国Avidity公布FSHD疗法最新临床数据:“DUX4调控基因减少50%以上,且功能呈现改善趋势”
面肩肱型肌营养不良症{FSHD}

面肩肱型肌营养不良症{FSHD}是一种进行性神经肌肉疾病,是一种继杜氏肌营养不良症{DMD/BMD}和强直性肌营养不良症{DM}后的第三大神经肌肉系统疾病,其发病率约为1/20,000。据估计,全世界有超过87万人患有FSHD疾病。FSHD为常染色体显性遗传,但大约20%~30%患者为新生突变,没有遗传史。根据分子遗传突变特征可以分为:FSHD1型和FSHD2型。FSHD1型约占95%。肌肉力量的逐渐丧失对患者日常生活和人生产生巨大影响。FSHD患者意味着生活在痛苦、疲劳和社会孤立中。最重要的是,由于疾病的进程无法预测,因此患者的未来变得不确定。约有20%的FSHD患者最终需要使用轮椅。目前,FSHD没有治疗或延缓疾病进展的药物。FSHD患者群体存在高度未被满足的临床需求。
第二批《罕见病目录》中编号为25.面肩肱型肌营养不良症{FSHD}。
FSHD为基因遗传疾病,FSHD可进行基因检测,生育需进行产前检测、PGT【胚胎植入前遗传学检测,也被称为三代试管婴儿技术】。目前针对FSHD疾病都可进行检测。
关于【你并不孤单FSHD患者关爱组织】

你并不孤单FSHD患者关爱组织{FSHD-China Patient Advocacy and Support Organization},由FSHD患者、FSHD患者家庭、FSHD医生专家组成,于2017年组建成立。FSHD-China致力于服务患者,科普FSHD疾病知识,开展疾病宣传活动,提高社会对于FSHD的疾病意识,定期举办中国FSHD医学研讨会和病友交流会,推进医学研究进程和促进国际交流与合作。FSHD-China为国际FSHD联盟正式成员组织。
官方网站:www.fshd-china.org
哔哩哔哩(bilibili.com)B站账号:你并不孤单FSHD
联系邮箱:fshd_china@163.com
微信公众号:ChinaFSHD
电话: 13206865756
E-mail:fshd_china@163.com
地址:黑龙江省牡丹江市西安区西一条路

















